Durante
el siglo XIX, los químicos comenzaron a clasificar a los elementos
conocidos de acuerdo a sus similitudes de sus propiedades físicas y
químicas. El final de aquellos estudios es la Tabla Periódica
Moderna
Johann
Dobereiner (1780 – 1849)
En
1829, clasificó algunos elementos en grupos de tres, que denominó
triadas. Los elementos de cada triada tenían propiedades químicas
similares, así como propiedades físicas crecientes.
En
1863 propuso que los elementos se ordenaran en “octavas”, ya que
observó, tras ordenar los elementos según el aumento de la masa
atómica, que ciertas propiedades se repetían cada ocho elementos.
La
propuesta de Newland fue ridiculizada en su momento por la comunidad
científica. Cuando intentó publicar su trabajo en la Chemical
Society, se le rechazó, aduciendo que dicha propuesta era tan
arbitraria como el haber sugerido un orden alfabético de los
elementos.
Dmitri
Mendeleev (1834 - 1907)
En
1869 publicó una Tabla de los elementos organizada según la masa
atómica de los mismos.
Propuso que si el peso atómico de un elemento lo situaba en el grupo incorrecto, entonces el peso atómico debía estar mal medido. Así corrigió las masas de Be, In y U.
Estaba tan seguro de la validez de su Tabla que predijo, a partir de ella, las propiedades físicas de tres elementos que eran desconocidos.
Tras el descubrimiento de estos tres elementos (Sc, Ga, Ge) entre 1874 y 1885, que demostraron la gran exactitud de las predicciones de Mendeleev, su Tabla Periódica fué aceptada por la comunidad científica.
Lothar
Meyer (1830 - 1895)
al
mismo tiempo que Mendeleeiev, Meyer publicó su propia Tabla
Periódica con los elementos ordenados de menor a mayor masa atómica.
Elementos
conocidos hasta entonces
Tanto
Mendeleev como Meyer ordenaron los elementos según sus masas
atómicas
Ambos
dejaron espacios vacíos donde deberían encajar algunos elementos
entonces desconocidos
Entonces,
¿porqué se considera a Mendeleev el padre de la Tabla Periódica
Moderna, y no a Meyer, o a ambos?
Henry
Moseley (1887 - 1915)
En
1913, mediante estudios de rayos X, determinó la carga nuclear
(número atómico) de los elementos. Reagrupó los elementos en
orden creciente de número atómico.
Existe
en el átomo una cantidad fundamental que se incrementa en pasos
regulares de un elemento a otro. Esta cantidad sólo puede ser la
carga del núcleo positivo central”
Glenn
T. Seaborg (1912 – 1999)
Tras
participar en el descubrimiento de 10 nuevos elementos, en 1944 sacó
14 elementos de la estructura principal de la Tabla Periódica
proponiendo su actual ubicación debajo la serie de los Lántanidos,
siendo desde entonces conocidos como los actínidos.
Es
la única persona que ha tenido un elemento que lleva su nombre en
vida.
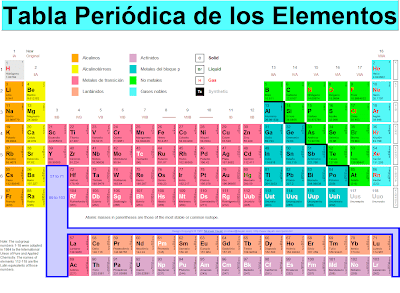
La
“Geografía” de la Tabla Periódica
El
conjunto de elementos que ocupan una línea horicontal se denomina
PERIODO.
Las
columnas verticales de la Tabla Periódica se denominan GRUPOS.stema
Los
elementos que conforman un mismo grupo presentan propiedades físicas
y químicas similares.



Comentad, por favor!!!
ResponderEliminar